166. Gli effetti dei gas in soluzione nei tessuti di un subacqueo
di Luca Cicali (articolo tratto da http://www.ocean4future.org )
|
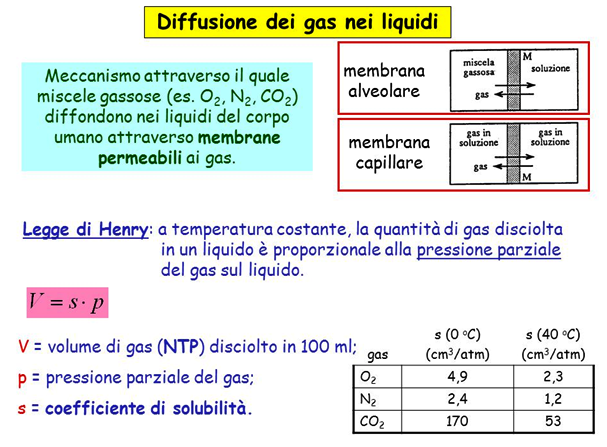
Il meccanismo di diffusione dei gas nel nostro corpo Vediamo qual è il meccanismo con il quale le miscele gassose, come ad esempio l’ossigeno, l’azoto e l’anidride carbonica, si diffondono nel nostro corpo. E’ un argomento un poco complesso da capire ma è fondamentale per arrivare a comprendere il perché abbiamo bisogno della decompressione. Le miscele gassose (ad esempio O2, N2, CO2) si diffondono nei tessuti del corpo umano attraverso le membrane permeabili ai gas seguendo la Legge di Henry la quale afferma che, a temperatura costante, la quantità di gas disciolta in un liquido è proporzionale alla pressione parziale del gas sul liquido. |
|
|
La
solubilità dei gas
|
La soluzione
Iniziamo cercando di definire cos’è una
soluzione: essa è costituita dall’unione di un
soluto, ovvero ciò che si scioglie, e un solvente ovvero
ciò che fa sciogliere il soluto. L’esperienza pratica ci aiuta a capire meglio questo concetto: se sciogliamo zucchero in un bicchiere d’acqua sappiamo che, dopo una certa quantità, ulteriori aggiunte di zucchero si sciolgono con sempre maggiore difficoltà, fino a quando lo zucchero in eccesso si ammassa sul fondo del bicchiere senza sciogliersi più. Questo significa che la soluzione acquosa di zucchero, è satura, ovvero lo zucchero è disciolto nell’acqua con una concentrazione pari alla sua solubilità.
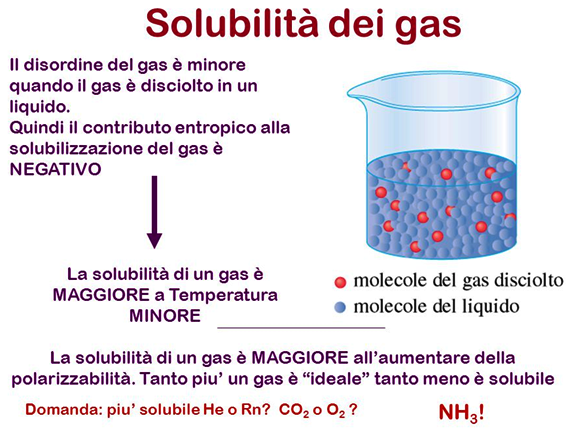
Come sappiamo, fortunatamente per noi subacquei, i gas sono generalmente poco solubili nei liquidi e la loro solubilità dipende, principalmente, dalla temperatura e dalla pressione del gas a contatto con il liquido, due fattori fondamentali per pianificare con sicurezza le nostre immersioni. |
|
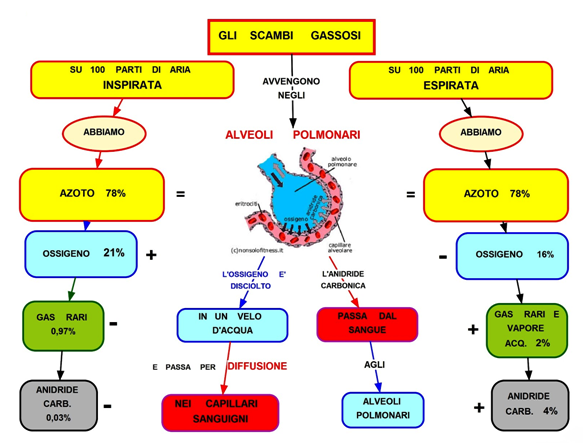
Lo scambio gassoso Quando respiriamo, i gas atmosferici giungono a stretto contatto con il sangue in apposite strutture specializzate dei polmoni, chiamate alveoli polmonari, tramite i quali entrano in soluzione nel sangue per ossigenarlo e rimuovere da esso l’anidride carbonica. Ma naturalmente anche tutti gli altri gas componenti dell’aria come azoto, gas nobili, e l’anidride carbonica giungono a tutti i tessuti dell’organismo. Pertanto, appena inizia una immersione, quantità aggiuntive di inerte entrano in soluzione nei tessuti secondo dinamiche complesse. La rimozione di tali gas durante la fase di ritorno alla pressione atmosferica non può avvenire in qualunque modo, come ben noto: la desaturazione deve essere graduale, in modo che siano rispettati alcuni precisi rapporti tra pressione ambiente e quantità di azoto disciolto. |
|
|
Quindi, maggiore è la pressione del gas e maggiore è la sua solubilità, ovvero la sua concentrazione finale alla saturazione, secondo un fattore C, detto coefficiente di assorbimento. Una maggiore pressione del gas comporta, infatti, un maggior numero di impatti delle sue molecole contro la superficie del liquido, parte delle quali vi restano intrappolate passando in soluzione. Il coefficiente di assorbimento che compare nella legge di Henry diminuisce all’aumentare della temperatura, quindi a temperature più basse i gas tendono a passare più facilmente in soluzione. Per questo motivo immersioni in acque fredde aumentano il rischio della MDD. In condizioni normali ed a pressione atmosferica (1 Atm), nei tessuti dell’organismo umano abbiamo circa 1 litro di azoto disciolto (N2). Applicando la legge di Henry ricaviamo proprio questo valore per l’azoto disciolto nei tessuti organici alla pressione parziale di 0,78 bar e alla temperatura di circa 35° centigradi ad 1 atmosfera (ovvero in superficie). |
|
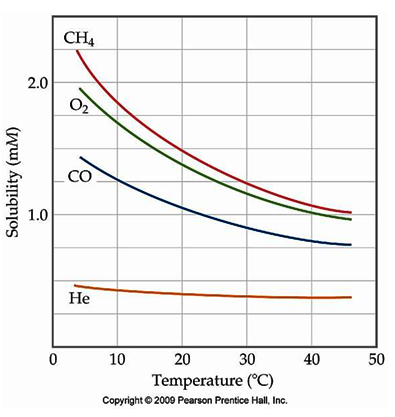
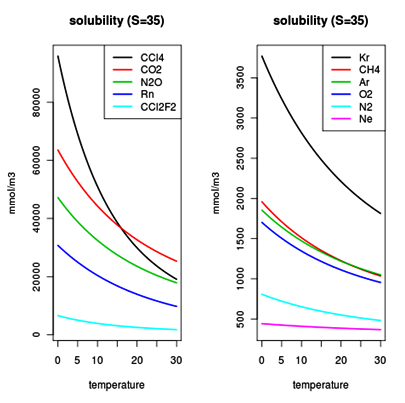 Come possiamo vedere nei due diagrammi la solubilità aumenta alle basse temperature, anche se in maniera differenziata, per tutti i gas.
|
Tensione di un gas in soluzione Il problema per noi subacquei sta nelle particolari modalità con le quali varia nel tempo la concentrazione del gas disciolto nei tessuti al variare della pressione del gas respirato. Per capire meglio occorre quindi condurre una piccola indagine fra differenti molecole di gas, concentrazioni e pressioni parziali, fino a definire la tensione di un gas in un tessuto. Sappiamo che se un liquido (ad esempio il sangue) o un tessuto organico (come i muscoli o le ossa), inizialmente privi di gas disciolto, vengono messi di colpo a contatto con un gas (come l’aria compressa) ad una certa pressione P, inizia a generarsi un flusso di molecole di gas che si sciolgono al suo interno. Nello stesso tempo avremo un ritorno delle molecole di gas disciolto dai tessuti e dai liquidi al gas. Di fatto, la concentrazione del gas disciolto inizia ad aumentare, generando a sua volta il flusso inverso e crescente di molecole che dal liquido riescono casualmente a fuoriuscire tornando al gas. L’equilibrio viene raggiunto quando la concentrazione di gas disciolto diviene pari alla solubilità e non può più aumentare, e i due flussi di molecole in entrata e uscita si equivalgono. La concentrazione del gas disciolto agisce quindi come una sorta di pressione interna del gas che si oppone a quella del gas premente sul liquido, e che contrasta l’ulteriore passaggio di gas in soluzione, rendendolo sempre più lento. Questa "pressione equivalente" è chiamata tensione del gas disciolto nel liquido, (solitamente indicata con T), e non è ovviamente misurabile con un manometro, perché non è una reale pressione, pur adottando le sue unità di misura. |
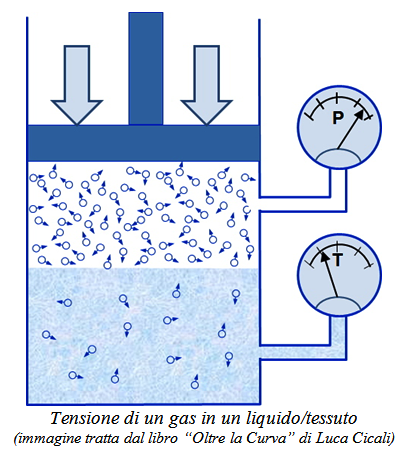 |
In conclusione, la saturazione è quindi la situazione in cui la tensione eguaglia la pressione del gas in ingresso, ovvero quando il gas disciolto ha raggiunto la concentrazione massima prevista dalla legge di Henry per determinate temperature e pressioni. Nel nostro ambiente abituale noi siamo saturi del gas (aria) che respiriamo, ovvero tutti i tessuti del nostro corpo (liquidi e solidi) contengono il massimo quantitativo possibile delle molecole di quel gas. Essendo l’aria composta principalmente da ossigeno ed azoto si verificano due situazioni. L’ossigeno viene in parte consumato nei processi respiratori per cui ne entra sempre più (21%) di quanto ne esce (16%), mentre l’azoto, che chiamiamo gas inerte, non venendo utilizzato dai nostri sistemi biologici, resta invariato (tanto ne entra 78% quanto ne esce 78%). Quando ci immergiamo la pressione aumenta (1 atmosfera ogni 10 metri) ed inizierà un movimento di gas dall’esterno verso l’interno fino a raggiungere un nuovo equilibrio che chiamiamo saturazione. |
Per maggiori approfondimenti, si consiglia la lettura del libro di Luca Cicali "Oltre la Curva".