|
155. il Forame Ovale Pervio (PFO)
|
A cura del Dr. Remo Albiero
Responsabile Emodinamica Istituto
Clinico San Rocco
Via dei Sabbioni 24
- 25050 Ome (Brescia)
http://www.panvascular.com/fs.htm?http://www.panvascular.com/pagine/info/pazienti/index.htm
|
|
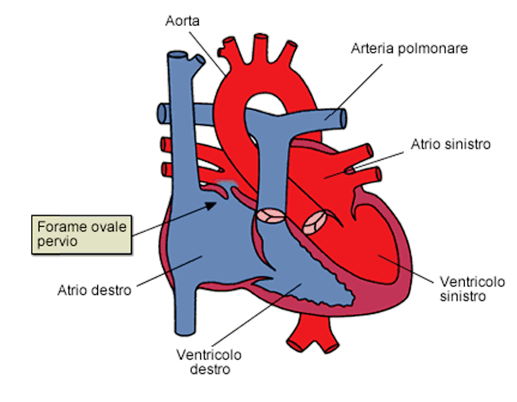
Cos'è il Forame Ovale Pervio (PFO)?
Il Forame Ovale Pervio, altrimenti
abbreviato con l'acronimo PFO, definisce un'anomalia
cardiaca in cui l'atrio destro comunica con il sinistro
a livello della fossa ovale tra septum primum e il
septum secundum.
Statisticamente interessa all'incirca il
25-30% della popolazione adulta.
In realtà la comunicazione tra i due atri
è assolutamente normale e anzi essenziale durante la
vita fetale, prima della nascita.
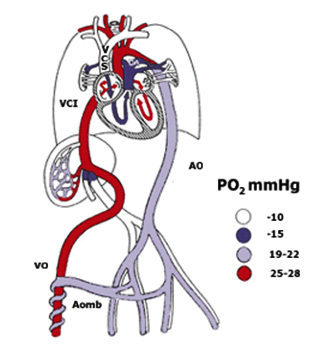
Durante la vita fetale (vedi figura
sotto) i polmoni sono inattivi e l'ossigeno che va ai
tessuti proviene dalla madre tramite la placenta e i
vasi del cordone ombelicale. Dovendo oltrepassare i
polmoni, il sangue fluisce direttamente dalla porzione
destra del cuore nella parte sinistra tramite due
aperture il dotto di Botallo posto tra l'arteria
polmonare e l'aorta toracica e il forame ovale che
connette i due atri. Alla nascita, la circolazione
placentare viene interrotta, i polmoni iniziano la loro
attività respiratoria e il piccolo circolo (cioè quello
polmonare) diventa pienamente funzionante. Le
modificazioni delle resistenze vascolari fanno sì che la
pressione atriale sinistra diventa leggermente superiore
a quella destra. Questa differenza di pressione fa
accollare al forame ovale una piccola membrana chiamata
septum primum. Normalmente, entro il primo anno di vita,
la membrana si salda alla parete e la chiusura diviene
permanente. |
 |
 |
Quando si parla di PFO?
Il forame ovale viene definito pervio (aperto), quando
questa saldatura non avviene e la chiusura anatomica
risulta imperfetta o manca completamente e quindi il
septum primum viene mantenuto in sede soltanto dalla
differenza pressoria. È come se avessimo una porta
semplicemente accostata e non chiusa con la serratura,
che si può aprire in un senso o nell'altro a seconda
della pressione esercitata ai due lati. Nelle normali
condizioni di vita, il PFO non comporta nessun problema.
Se invece la pressione nell'atrio destra supera quella
dell'atrio sinistro, ci può essere un passaggio (shunt)
di sangue nell'atrio sinistro. Il volume di sangue che
viene deviato dipende, oltre che al gradiente pressorio,
anche dalle dimensioni dell'apertura e ambedue variano
di volta in volta.
Un forame ovale pervio (PFO) è stato riscontrato a
livello autoptico (cioè all'autopsia sul cadavere) nel
25-35% della popolazione adulta senza differenza di
sesso. Utilizzando l'ecocontrastografia,
un PFO si può rilevare nel soggetto vivente ("in vivo")
nel 5-20% della popolazione adulta. Queste percentuali
sono diverse perchè all'autopsia si vede direttamente la
parte anatomica (cioè il setto interatriale), mentre
l'ecocardiografia con ecocontrasto si basa sulla misura
indiretta di un fenomeno fisiologico.
|
 |
|
Quali sono le persone che dovrebbero
essere interessate al PFO?
1. Pazienti giovani (di età inferiore ai 60 anni),
colpiti da uno o più episodi di ischemia cerebrale la
cui causa non sia stata determinata ("criptogenetica") e
si sospetti una embolia cerebrale "paradossa". La causa
di un episodio di ischemia cerebrale rimane sconosciuta
("criptogenetica") nel 35-40% dei casi.
2. I subacquei colpiti da forme gravi
di malattia da decompressione, dopo immersioni eseguite
nel rispetto delle tabelle. |
|
Quando va fatto l'esame specifico per
il PFO?
Il PFO non provoca alcuna anomalia all'esame fisico e
radiologico nè all'elettrocardiogramma. Raramente da
manifestazioni patologiche, per cui molti non sanno
assolutamente di averlo. Esistono vari metodi di
indagine che accoppiano tecniche contrastografiche
all'uso di ultrasuoni e che consentono di valutare lo
stato delle strutture cardiache e del flusso di sangue,
sia normale che patologico (ecocontrastografia bidimensionale
ad alta definizione, ecocardiografia color doppler). In
pratica, viene iniettata in vena una soluzione salina
contenente microbolle che, una volta giunte al cuore,
permettono di rilevare il tipo e l'entità di un
eventuale shunt. Il metodo Doppler visualizza molto bene
le bolle gassose e la direzione del flusso circolatorio,
che apparirà in blu quando è in allontanamento dalla
sonda e in rosso quando si sposta in direzione opposta.
L'uso della soluzione salina con microbolle non ha
evidenziato nessuna conseguenza particolare e la
metodica è considerata pressoché sicura. La sensibilità
diagnostica aumenta se questo esame viene associato alla
manovra di Valsalva. Se è presente un PFO,
l'ecocardiografia con ecocontrasto metterà in evidenza
il passaggio dall'atrio destro a quello sinistro di
microbolle nella fase transitoria di aumento della
pressione in atrio destro. La dimostrazione di un PFO
mediante ecocontrastografia è
strettamente correlata con i risultati del cateterismo
cardiaco. Quando usata in associazone alla manovra di
Valsalva, l'ecocontrastografia ha rilevato il 60% dei
PFO che sono stati rilevati al cateterismo cardiaco, e
quando usata in associazione al test del colpo di tosse
è stato rilevato nel 78% dei casi. Una tecnica di più
recente introduzione è l'ecocardiografia
transesofagea color doppler, che si esegue
introducendo una sonda in esofago previa una blanda
sedazione del paziente. La più stretta vicinanza tra il
trasduttore e il cuore porta a migliori risultati con
una sensibilità diagnostica del PFO del 100%.
|
|
I pazienti con episodi di ischemia
cerebrale da sospetta "embolia paradossa"
L'embolia paradossa viene ritenuta responsabile di un
episodio di ischemia cerebrale quando:
1. non è presente una fonte
trombo-emboligena nelle sezioni cardiache di sinistra,
2. vi è la possibilità di uno shunt
(passaggio di sangue) tra le sezioni destre e sinistre
del cuore, e
3. viene rilevato un trombo nel
sistema venoso o nell'atrio destro.
Dal momento che il rilievo di un trombo all'interno del
PFO è di raro riscontro, la diagnosi di embolia
paradossa è di solito presuntiva. Le condizioni che in
presenza di un PFO determinano un'embolia paradossa si
ritiene siano le seguenti:
1. un aumento cronico della pressione
nell'atrio destro con conseguente shunt destro-sinistro
(ad esempio ipertensione polmonare, BPCO, embolia
polmonare),
2. un aumento transitorio della
pressione atriale destra che si verifica al termine di
un aumento della pressione dell'aria nei polmoni
(manovra di Valsalva, tosse, immersioni) e
3. differenze cicliche della pressione
tra i due atri con transitori shunt tra l'atrio destro e
il sinistro.
Mentre non c'è attualmente alcuna prova
sicura di un rapporto causa-effetto, numerosi studi
hanno comunque confermato una forte associazione tra la
presenza di un PFO e il rischio di embolia paradossa o
di episodi di ischemia cerebrale. Quando confrontati con
un gruppo di soggetti di controllo senza PFO, i pazienti
con PFO hanno un rischio di soffrire di un evento
trombo-embolico che è quattro volte più alto; tale
rischio è 33 volte maggiore nei pazienti che hanno sia
il PFO che un aneurisma del setto interatriale. Inoltre,
la presenza di un forame ovale ampiamente pervio (con
separazione tra septum primum e septum secundum >5mm) o
con ampio shunt destro-sinistro (più del 50% dell'atrio
sinistro riempito da ecocontrasto) sono state
identificati come predittori ecocardiografici di un
aumentato rischio di embolia paradossa. Infine, ci sono
sempre più dati che evidenziano come i pazienti con PFO
ed embolia paradossa hanno un rischio aumentato di
future recidive di ischemia cerebrale.
Uno studio retrospettivo, multicentrico eseguito in
Francia ha dimostrato che il rischio annuo di avere una
recidiva di ischemia cerebrale transitoria (TIA) è
dell'1.2%, e del 3.4% di avere una recidiva di ictus
cerebrale o di TIA; le stesse percentuali di recidiva di
eventi ischemici cerebrali si verificano anche nei
pazienti con PFO e pregressi episodi di ischemia
cerebrale "criptogenetica" che assumono una terapia
medica profilattica con farmaci anticoagulanti o
antiaggreganti piastrinici. I dati di questo studio
francese sono confermati da quelli di uno studio
svizzero condotto a Losanna, in cui la recidiva di ictus
ischemico cerebrale in 140 pazienti con PFO e pregresso
ictus è stata dell'1.9% all'anno, mentre la percentuale
combinata di ictus e TIA è stata del 3.8% all'anno. |
|
I subacquei colpiti da forme gravi di
malattia da decompressione dopo immersioni eseguite nel
rispetto delle tabelle
(le cd. MDD immeritate)
Le bolle gassose originate dopo ogni immersione
subacquee si formano all'interno delle vene e non nel
sangue arterioso. Quest'ultimo presenta una pressione
più elevata, non è quasi mai sovrasaturo e non riceve
gas direttamente dai tessuti. Le bolle formatesi sono
piccole e non provocano sintomi poichè si arrestano a
livello dei capillari polmonari e vengono gradatamente
espulse con la respirazione (microbolle). In definitiva
rimangono confinate alla circolazione venosa, la quale
non ha nessuna funzione nutritizia ma costituisce una
sorta di via di scarico per le sostanze che vanno
eliminate dall'organismo. Un PFO consentirebbe a queste
bolle altrimenti asintomatiche di entrare nel circolo
arterioso, poiché la separazione tra i due atri non è
ermetica. Inoltre, questo passaggio potrebbe associarsi
a turbolenze e creare nuovi nuclei gassosi. Il filtro
polmonare perderebbe così l'importante funzione di
blocco ed eliminazione dei gas in eccesso residuati
dall'immersione. Queste bolle farebbero come un ospite
indesiderato che entra nella porta di servizio, evitando
di essere respinto all'ingresso da un cortese ma deciso
portiere (i polmoni). Se poi la decompressione è stata
inadeguata, la gran quantità di bolle presenti potrebbe
congestionare i polmoni far alimentare la pressione in
atrio destro e spingerne una certa quantità nel circolo
arterioso. L'inversione del gradiente pressorio, per un
transitorio alimento della pressione venosa, si potrebbe
verificare anche durante una manovra di compensazione
forzata come il Valsalva, della quale sono noti gli
effetti del piccolo circolo. Il Valsalva alimenta la
pressione nella parte destra del cuore e può
incrementare uno shunt in caso di PFO o di altro difetto
settale. Inoltre, anche rapidi cambi di posizione o di
orientamento, sollecitazioni improvvise, stress termici,
tosse, vomito, mute o cinghiaggi troppo stretti
potrebbero dare origine a transitori aumenti di
pressione. Infine, qualche cenno sui possibili effetti
indotti dalla posizione di Trendelemburg, ormai peraltro
poco usata, nel caso la vittima dell'incidente sia
portatore di PFO. È stato visto che gli effetti sullo
shunt non sono consistenti, poichè l'innalzamento delle
gambe fa aumentare la pressione simultaneamente in
ambedue i compartimenti sia destro che sinistro. |
|
Il PFO è realmente un fattore di
rischio?
Nel già citato studio di Moon, il 61% dei subacquei
colpiti da forme gravi di MDD(malattia da
decompressione) presentava un PFO. Successivamente
Wilmhurst trovò che molti individui con sintomatologia
da MDD dopo immersioni nel rispetto delle tabelle
evidenziavano shunts destro-sinistri. Venne attribuita
un'incidenza di PFO del 66% in coloro che presentavano
sintomi precoci di MDD (entro 30 minuti
dall'immersione), a fronte di un dato del 17% tra chi
aveva manifestato più tardivamente i segni
dell'incidente da decompressione. Il tempo che
intercorre tra l'emersione e l'inizio dei sintomi è
tanto più breve quanto più rilevante e immediato è
l'interessamento del circolo arterioso. Il Divers Alert
Network (DAN) definisce come immeritati quegli incidenti
non giustificati da chiari errori di risalita o di
decompressione. Uno studio specifico compiuto da tale
organizzazione considerava la possibilità che tali
incidenti venissero favoriti dalla presenza di un PFO. I
dati non ancora definivi evidenziano una significativa,
maggiore incidenza del PFO nelle patologie da
decompressione di tipo celebrale: la percentuale è del
62% in chi ha subito un incidente da decompressione, del
88% nei casi con ripercussioni cerebrali e del 40% se
presenti sintomi neurologici periferici. In un articolo
di Moon diffuso recentemente nella traduzione italiana,
viene rilevato come circa il 50%) dei soggetti
sofferenti di gravi forme neurologiche di Mdd presenti
una pervietà del forame orale, attribuendo loro una
probabilità 5 volte maggiore di venir colpiti da forme
severe di MDD. La predisposizione riguarderebbe anche le
forme cardiorespiratorie e cutanee di MDD ma non le
localizzazioni articolari. Altri studiosi ritengono
invece che il legame tra shunt e MDD continui a rimanere
controverso. I dati a sostegno di questa valutazione
considerano, per esempio, che dei 50.000 sub praticanti
in Gran Bretagna, circa 15.000 dovrebbero presentare un
PFO. Ebbene, ogni anno vengono osservati circa 100 casi
di MDD di tipo neurologico, e cioè indica che il fatto
di avere lo shunt non necessariamente deve portare a MDD.
Uno shunt potrebbe si incrementare il rischio di
incidente con sintomi neurologici, ma tale rischio
rimane comunque molto basso in termini di popolazione. |
|
Terapia medica profilattica contro
l'embolia paradossa in presenza di PFO
La presenza di un PFO o di un aneurisma del setto
interatriale non necessita di una profilassi
farmacologica nei soggetti che non hanno sofferto in
precedenza di episodi di ischemia cerebrale. Al
contrario, ai pazienti con PFO che hanno già avuto un
ictus cerebrale o un TIA e in cui non è stata
evidenziata nessun altra causa responsabile dell'evento
ischemico cerebrale (forma detta "criptogenetica") viene
consigliata una terapia profilattica (preventiva) per
diminuire la percentuale annua di recidive
tromboemboliche. I pazienti vengono generalmente
trattati con anticoagulanti orali (Coumadin, Sintrom) o
antiaggreganti piastrinici (aspirina, ticlopidina o
clopidogrel, ecc). A tutt'oggi, comunque, non c'è un
consenso su quale trattamento sia il più efficace (gli
anticoagulanti orali piuttosto che gli antiaggreganti
piastrinici), o per quanto tempo la terapia medica debba
essere protratta dopo che è comparso un evento ischemico
cerebrale. Nello studio di Losanna, ad esempio, non sono
state rilevate differenze nella riduzione del rischio di
recidive di ictus o TIA tra i differenti tipi di terapia
profilattica anticoagulante o antiaggregante assunta. |
|
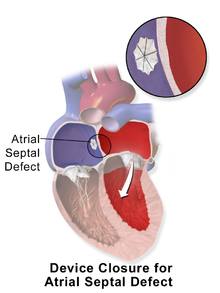
Chiusura non chirurgica (per via
percutanea) dei PFO
La chiusura non chirurgica dei PFO è diventata possibile
con l'avvento dei sistemi di chiusura transcatetere,
inizialmente sviluppati per la chiusura percutanea dei
difetti interatriali (DIA). LA prima chiusura per via
percutanea di un DIA con un doppio-ombrellino di Dacron
è stata eseguita nel 1974. Da allora, sono stati
introdotti numerosi nuovi sistemi di chiusura percutanea
che sono stati utilizzati con successo in ambito clinico
(cioè impiantati in esseri umani). Tra i sistemi di
chiusura utilizzati in ambito clinico ricordiamo il
sistema a bottone Sideris, il sistema Sideris
auto-centrante, il sistema Angel Wings e il sistema
Cardioseal.
Il principale svantaggio dei primi sistemi di chiusura
percutanea dei PFO appena citati consiste nel fatto che
alcuni di essi sono tecnicamente difficili da
impiantare, oppure sono a rilascio incontrollato, o non
sono recuperabili a causa della loro forma e
costruzione. Uno degli ultimi sistemi sviluppati
(denominato "AMPLATZER
PFO Occluder") ha risolto quasi tutti questi
svantaggi: è facile da impiantare con un rilascio
controllato ed è facilmente recuperabile. E' perciò
diventato, nei centri specializzati in questo tipo di
interventi, uno dei sistemi più utilizzati in
alternativa alla terapia anticoagulante (non esente da
effetti indesiderati come emorragie, ematomi, necrosi o
gangrena cutanea, o interazione con altri farmaci) o a
quella chirurgica (sicuramente più traumatica) nei
pazienti con PFO ed episodi di embolia paradossa
associata ad ischemia cerebrale. |
|
Chiusura non chirurgica (per via
percutanea) del forame ovale pervio (PFO)
mediante "AMPLATZER PFO Occluder" |
|
Cosa accade prima, durante e dopo
la procedura
La procedura si svolge nel
laboratorio di Emodinamica,
dove opera
personale altamente specializzato ed addestrato.
Il paziente, posto sul lettino di cateterismo,
viene attentamente seguito e valutato attimo per
attimo in tutte quelle che sono le funzioni
vitali (polso, pressione, ritmo cardiaco) e
vengono approntate tutte le misure
farmacologiche e non farmacologiche atte a
contrastare eventuali urgenze. Il paziente dovrà
avere in precedenza effettuato un bagno o una
doccia ed essere stato sottoposto alla rasatura
dei peli nella zona attraverso la quale verrà
introdotto il catetere.
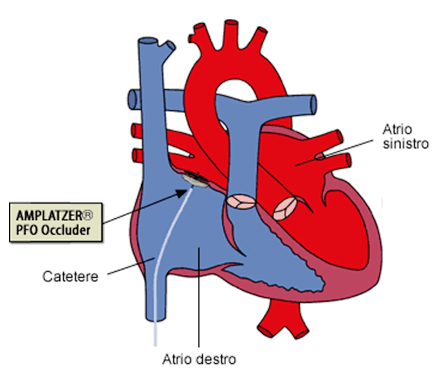
Dopo aver effettuato l'anestesia
locale nel punto di accesso cutaneo, il
cardiologo interventista (che chiameremo
"operatore") introduce in una vena (quasi sempre
quella femorale a livello dell'inguine) un
tubicino (introduttore) di calibro adeguato a
contenere il catetere che servirà per
attraversare il
PFO.
|
|
 |
Un secondo medico
ecocardiografista potrebbe eseguire un
ecocardiogramma transesofageo (ETE)
durante la procedura di chiusura del PFO. Questo
tecnica di immagine agevola il medico operatore
nel posizionamento corretto dell'ombrellino a
livello del PFO prima del suo rilascio
definitivo.
Il cardiologo interventista
(l'operatore) può eseguire la misura della
saturazione di ossigeno in alcune cavità
cardiache (cateterismo
destro).
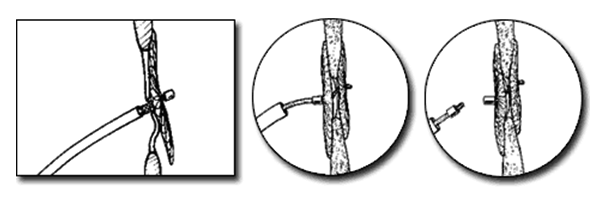
L'ombrellino ("AMPLATZER PFO Occluder") di
dimensioni adeguate al PFO da chiudere (il più
usato è quello da 25 mm di diametro) viene
avvitato su uno speciale catetere, viene poi
inserito in un lungo introduttore e fatto
avanzare (sempre chiuso nel catetere) attraverso
il PFO.

L'operatore spinge l'ombrellino fuori
dall'introduttore in modo tale che i suoi due
dischi aperti si aprano su ciascun lato del
forame ovale pervio (PFO), cioè uno
in atrio sinistro e l'altro in atrio destro.
|
|
Quando l'operatore, sulla base dei dati
angiografici, delle manovre eseguite per il
controllo della stabilità del sistema,
dell'esecuzione di un'angiografia e/o di uno
studio ecocontrastografico, e delle immagini
ecocardiografiche (ETE), è soddisfatto della
posizione del sistema di chiusura, esegue il suo
rilascio definitivo svitando l'ombrellino dal
catetere su cui era stato montato e che era
stato usato per spingerlo in atrio sinistro.
Il sistema "AMPLATZER PFO Occluder" è ora
definitivamente impiantato nel cuore.
Il catetere, l'introduttore
venoso e la sonda transesofagea (nel caso venga
usata) vengono rimossi e la procedura è
terminata.
La procedura dura generalmente
1-2 ore, ed è sicuramente molto meno invasiva di
un intervento chirurgico a torace aperto. Il
paziente viene generalmente dimesso il mattino
successivo, ma potrebbe anche essere dimesso la
sera stessa dell'intervento se questo viene
eseguito al mattino. |
|
 |
 |
|
Cosa aspettarsi dopo la
procedura
Se non ci sono complicazioni, la dimissione
avviene il mattino successivo oppure la sera
stessa dell'intervento se questo viene eseguito
al mattino. Prima di lasciare l'ospedale viene
eseguito un
ecocardiogramma transtoracico (ETT) per
verificare il persistente corretto
posizionamento del sistema di chiusura.
Dal momento che la procedura di chiusura per via
percutanea del PFO è meno invasiva di quella
chirurgica a torace aperto, anche il recupero
(periodo di convalescenza) è molto più facile.
Il paziente viene dimesso con un cerotto adesivo
a livello dell'inguine dove era stato introdotto
il catetere. Qualche volta rimane un lieve
fastidio in gola come conseguenza dell'eco
transesofageo (ETE) nel caso questo venga
eseguito.
Prima della dimissione vengono dati dei consigli
sul tipo di attività che può essere svolta e sul
farmaci da assumere (viene solitamente
consigliata un terapia antiaggregante
piastrinica (per sciogliere il sangue)
associando aspirina (da 100 a 300 mg al giorno)
e clopidogrel (Plavix o Iscover 1 cp da 75 mg al
giorno) per almeno 6 mesi. Informare subito il
medico se i farmaci consigliati determinano
degli effetti indesiderati, ma non sospenderli
assolutamente di propria iniziativa prima di
aver avvertito il cardiologo, il quale potrà
suggerire quale altro farmaco può essere assunto
in alternativa.
Oltre alla terapia antiaggregante piastrinica è
necessario assumere degli antibiotici prima di
sottoporsi a particolari interventi (vedi
prevenzione dell'endocardite batterica). La
decisione di proseguire la terapia
antiaggregante piastrinica oltre i 6 mesi è a
discrezione del medico/cardiologo curante.
E' importante ritornare alle visite programmate
di controllo per l'esecuzione di degli
ecocardiogrammi di controllo, che vengono
normalmente prescritti nel primo anno dopo
l'impianto. |
Torna su all'inizio della pagina
|
|
|









